焦点新闻
2025-01-06
卡瑞利珠单抗用于非小细胞肺癌合并脑转移研究荣登《柳叶刀·肿瘤学》
2025年1月3日,由浙江省肿瘤医院范云教授团队牵头开展的一项卡瑞利珠单抗联合脑部放疗及含铂双药化疗治疗初治晚期非小细胞肺癌合并脑转移患者的多中心、单臂的ⅱ期临床研究(c-brain)于国际肿瘤学领域顶级期刊《柳叶刀·肿瘤学》《the lancet oncology》(if:41.6)1在线发表。
c-brain研究是全球首个将放疗与免疫和化疗联合应用于晚期驱动基因阴性非小细胞肺癌(nsclc)脑转移患者的前瞻性研究,首次探索了卡瑞利珠单抗联合化疗及局部放疗在nsclc脑转移患者中的疗效和安全性,有望为此类患者提供全新的治疗选择。

范云教授领衔c-brain研究发布于the lancet oncology
01 研究背景
脑转移与nsclc的不良预后密切相关;20-30%的nsclc患者在初次诊断时合并脑转移,显著影响患者的生存和生活质量2,3。由于化疗药物不能有效穿透血脑屏障,手术切除及放疗是nsclc脑转移综合治疗中的重要手段,但疗效欠佳。针对这一未满足需求,研究者前期开展了pd-1/pd-l1单抗单药或者联合化疗治疗nsclc脑转移患者的小样本、前瞻性研究,纳入人群主要为无症状、小病灶患者群体。然而在临床实践中,有症状或病灶较大的脑转移患者常常需要联合脑部放疗。既往研究提示,脑部放疗联合免疫治疗具有协同抗肿瘤活性,似乎是伴脑转移nsclc患者的一种潜在治疗手段4。但目前相关研究开展较少,仍缺乏较为明确的应用证据。因此,如何有效治疗脑转移患者是临床医生必须考虑的问题。
卡瑞利珠单抗是恒瑞医药自主研发的一种人源化igg4单克隆抗体,其联合铂类双药化疗已在中国获批用于晚期nsclc患者的一线治疗5,6。2023年,ⅱ期cap-brain研究显示了卡瑞利珠单抗联合治疗方案作为晚期非鳞状nsclc伴脑转移患者一线治疗的潜力7。本项ⅱ期研究,旨在研究卡瑞利珠单抗联合脑放疗和铂类双药化疗在未经治疗的晚期非鳞状和鳞状nsclc伴脑转移患者中的疗效和安全性。
02 研究方法
2020年5月6日至2023年1月30日,共纳入65例nsclc合并脑转移患者接受了卡瑞利珠单抗联合脑部放疗及含铂双药治疗。主要研究终点为6个月无进展生存(pfs)率。次要终点包括recist v1.1定义pfs、颅内pfs(ipfs)、总体客观缓解率(orr)、颅内客观缓解率(iorr)、疾病控制率(dcr)、总生存期(os)和安全性。

图1. 研究设计
研究纳入影像学诊断的nsclc脑转移(≥5 mm)患者,对脑转移病灶的最大直径、数量及中枢神经系统症状没有限制,根据recist v1.1标准至少有可测量的靶病灶,无egfr/alk/ros1突变,ecog ps为0或1分,预期寿命≥3个月。
患者按脑部病灶数量接受不同局部治疗方案:脑转移灶(bms)为1~4个的患者原则上接受立体定向放射外科(srs)20-35 gy,1~5分次;bms≥5个的患者原则上接受全脑放射治疗(wbrt)3.0 gy*10分次。在开始srs或wbrt的7天内进行卡瑞利珠单抗200 mg q3w,在卡瑞利珠单抗治疗第1个或第2个疗程联合含铂双药化疗。
03 研究结果
研究共入组了65例患者,46例(71%)患者在入组时有症状性脑转移。截至2023年12月13日,中位随访时间为14.1个月,19例(29%)患者仍在接受卡瑞利珠单抗维持治疗。65例患者中有39例(60%)接受了srs治疗,24例(37%) 患者接受总剂量为30 gy(每次3 gy)的wbrt。卡瑞利珠单抗的中位治疗周期数为7(iqr:4-11),铂类双药化疗的中位治疗周期数为4(iqr:3-4)。从脑部放疗到免疫治疗的中位时间间隔为2天(iqr:1-6)。
1.临床疗效
在全分析集(fas)中,主要终点6个月pfs率为71.7%(95% ci:58.9%-81.1%),中位pfs为10.7个月(95% ci:7.5-15.7),中位ipfs为16.1个月(95% ci:13.0-nr),中位os为20.9个月(95% ci:13.8-27.7)。
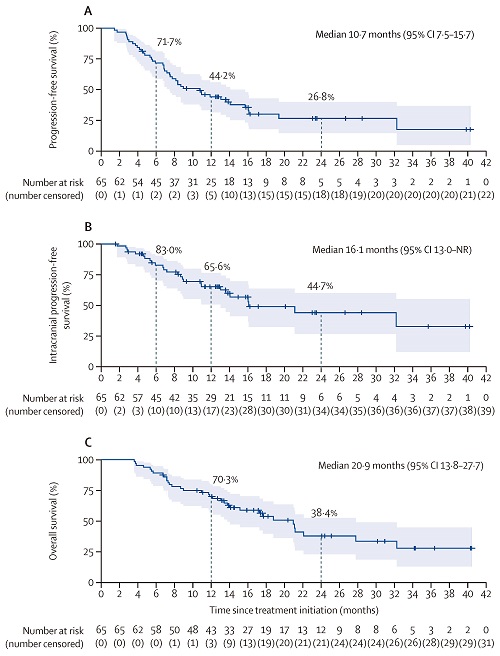
图2:pfs(a)、ipfs(b)及os(c)的kaplan-meier曲线
(依据recist 1.1标准)
在fas中,iorr为78.5%(95% ci:66.5%-87.7%),颅内疾病控制率(idcr)为98.5%(95% ci:91.7%-100%),颅外病灶的orr为69.2%(95% ci:56.6%-80.1%),dcr为93.8%(95% ci:85.0%-98.3%);
对于可评估中枢神经系统病灶疗效(cefr)的患者,iorr为82.5%(95% ci:70.1%-91.3%),idcr为98.2%(95% ci:90.6%-100%),orr为70.2%(95% ci:56.6%-81.6%),dcr为96.5%(95% ci:87.9%-99.6%)。
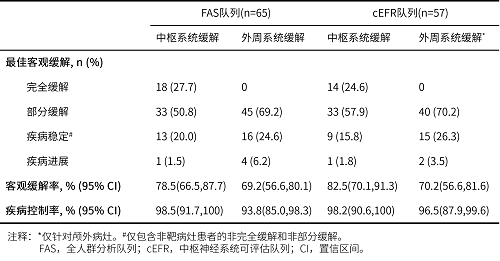
表1. 颅内和全身肿瘤缓解
脑部靶病灶的最佳百分比变化中位值为68.3%(iqr:38.8%-100.0%)。全身缓解中位时间为1.8个月(95% ci:1.5-2.2),全身缓解的中位持续时间为9.5个月(95% ci:6.1-14.6)。整体靶病灶的最佳百分比变化中位值为46.9%(iqr:30.3-67.7)。
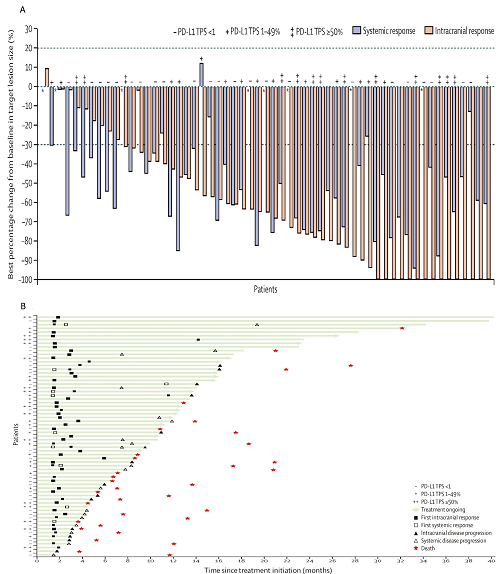
图3. cefr中颅内或整体靶病灶直径总和与基线相比的最佳百分比变化
(a.条形颜色表示根据recist 1.1的最佳颅内或全身反应。*表示颅内或全身靶病灶直径总和与基线相比无变化[0%]的患者;b.显示fas队列颅内和整体靶病变的反应时间和反应持续时间)
2.安全性
卡瑞利珠单抗联合脑部放疗及含铂双药化疗治疗初治晚期非小细胞肺癌合并脑转移患者安全性整体可控。
04 研究结论
卡瑞利珠单抗联合脑部放疗及含铂双药化疗显示出良好的疗效和可控的安全性,有望为非小细胞肺癌脑转移患者提供全新的治疗选择。同时期待后续进一步开展随机对照试验。
参考文献:
[1].xu, yanjun et al. brain radiotherapy combined with camrelizumab and platinum-doublet chemotherapy for previously untreated advanced non-small-cell lung cancer with brain metastases (c-brain): a multicentre, single-arm, phase 2 trial. the lancet oncology, volume 26, issue 1, 74 – 84.
[2].cagney dn, martin am, catalano pj, et al. incidence and prognosis of patients with brain metastases at diagnosis of systemic malignancy: a population-based study. neuro oncol. 2017;19(11):1511-21.
[3].gillespie cs, mustafa ma, richardson ge, et al. genomic alterations and the incidence of brain metastases in advanced and metastatic nsclc: a systematic review and meta-analysis. j thorac oncol. 2023;18(12):1703-13.
[4].yang yin, deng lei, yang yufan, et al. efficacy and safety of combined brain radiotherapy and immunotherapy in non-small-cell lung cancer with brain metastases: a systematic review and meta-analysis.[j] .clin lung cancer, 2022, 23: 95-107.
[5].zhou c, chen g, huang y, et al. camrelizumab plus carboplatin and pemetrexed versus chemotherapy alone in chemotherapy-naive patients with advanced non-squamous non-small-cell lung cancer (camel): a randomised, open-label, multicentre, phase 3 trial. lancet respir med 2021; 9: 305–14.
[6].ren s, chen j, xu x, et al. camrelizumab plus carboplatin and paclitaxel as first-line treatment for advanced squamous nsclc (camel-sq): a phase 3 trial. j thorac oncol 2022; 17: 544–57.
[7].hou x, zhou c, wu g, et al. efficacy, safety, and health-related quality of life with camrelizumab plus pemetrexed and carboplatin as first-line treatment for advanced nonsquamous nsclc with brain metastases (cap-brain): a multicenter, open-label, singlearm, phase 2 study. j thorac oncol 2023; 18: 769–79.