新闻速递
2024-06-15
2024 eular︱创新药艾玛昔替尼、夫那奇珠单抗共3项风湿领域研究成果亮相
6月12日至6月15日,2024欧洲风湿病学大会(eular年会)在奥地利维也纳隆重召开。作为风湿病领域最具影响力的国际会议之一,全球顶尖专家齐聚于此,紧扣临床热点和疑难问题进行探讨和分享。大会期间,jak1抑制剂艾玛昔替尼片(shr0302)、il-17a抑制剂夫那奇珠单抗(shr-1314)两款1类创新药在内的3项重磅研究成果亮相。
艾玛昔替尼片(shr0302)
治疗中至重度活动性类风湿关节炎研究结果公布
类风湿关节炎(rheumatoid arthritis, ra)是一种以侵袭性、对称性多关节炎为主要临床表现的慢性、全身性自身免疫性疾病,janus激酶(jak)抑制剂的上市改善了ra治疗的格局,其口服给药、单药疗效显著的特点为一线用药耐受性欠佳或应答不足的ra患者带来了新选择。目前,美国fda和ema已批准了三种口服jak抑制剂用于治疗ra。shr0302是一种口服高选择性jak1抑制剂,可通过抑制jak1信号传导发挥抗炎和抑制免疫的生物学效应。
由北京协和医院曾小峰教授牵头开展的“评价shr0302治疗传统合成改善病情抗风湿药反应不佳的中至重度活动性ra受试者的疗效与安全性的多中心、随机、双盲、安慰剂对照的ⅲ期临床研究”结果入选本次eular大会口头报告。北京时间6月12日开幕式当天,该研究sub-pi北京协和医院刘金晶教授在大会主会场报告了该研究的最新数据(摘要号:op0037)[1]。研究表明[1],shr0302 4mg和8mg在控制ra的体征和症状,以及改善健康相关结局方面均具有有效性、起效快、整体安全性可控、耐受性良好的特点。

2024 eular大会现场图:刘金晶教授进行口头报告
研究设计
本研究包括24周核心治疗期和28周延伸治疗期。研究纳入对传统合成改善病情抗风湿药(csdmards)反应不佳的中至重度活动性ra受试者,按照1:1:1的比例随机分配至安慰剂组、shr0302 4mg组或shr0302 8mg组,每天一次,连续口服24周。随后,shr0302 4mg 组和shr0302 8mg 组维持原治疗方案至治疗期结束,原安慰剂组受试者在延伸治疗期开始服用shr0302 4mg,每天一次,直至治疗期结束。研究主要终点为给药24周时美国风湿病学会ra疾病活动评估核心标准达到20%改善(acr20)的受试者比例。
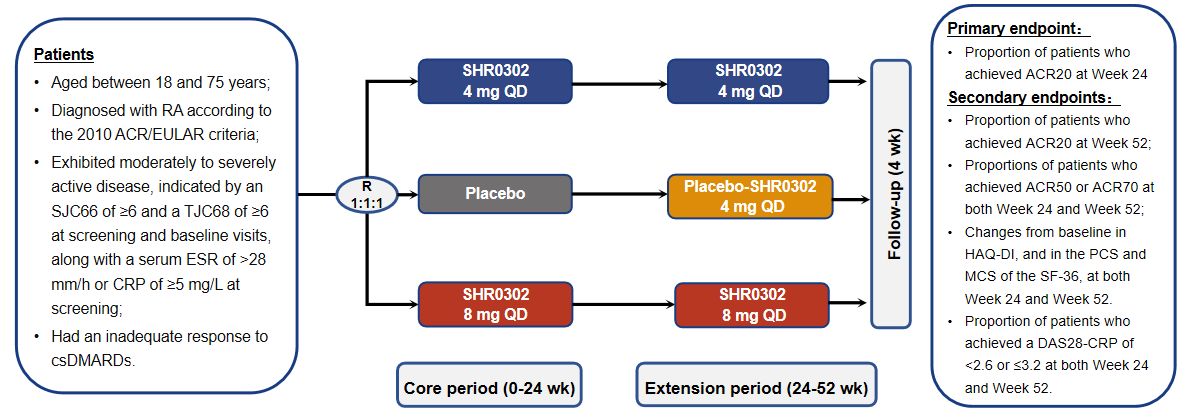
图1 研究设计
该研究于2020年7月至2023年9月期间共纳入566例中至重度活动性ra受试者,所有受试者均至少服用了一剂研究药物。各组受试者的基线人口学特征和ra疾病人群特征相似。其中,524例(92.6%)受试者完成了24周的治疗,496例(87.6%)受试者完成了52周的治疗。结果显示:
疗效方面:
第24周,shr0302 4mg和8mg组的acr20应答率分别为70.4%和75.1%,显著高于安慰剂组的40.4%(p<0.0001, p<0.0001);同样,与安慰剂组相比,shr0302 4mg和8mg组在acr50应答率(46.0%, 57.1% vs. 15.4%;p<0.0001, p<0.0001)和acr70应答率(22.2%, 31.7% vs. 6.9%;p<0.0001, p<0.0001)方面也有明显改善(图2)。
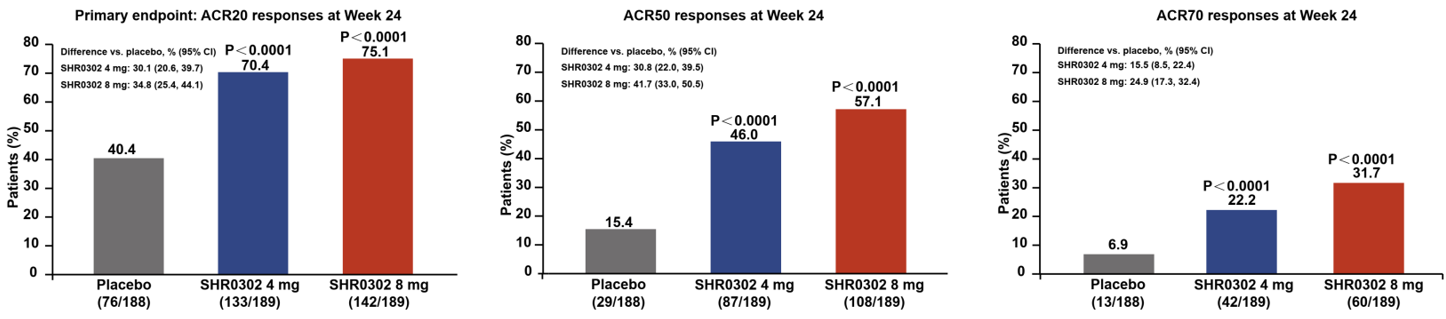
图2 各组受试者在治疗24周后acr20、acr50、acr70应答率
此外,第24周,shr0302 4mg组和8mg组达到das28-crp(基于c反应蛋白水平的28个关节疾病活动度评分,得分越高,疾病越严重)<2.6(29.6%, 39.2% vs. 4.8%;p<0.0001, p<0.0001)和≤3.2(46.0%, 57.1% vs. 15.4%;p<0.0001, p<0.0001)的受试者的比例均显著高于安慰剂组(图3)。
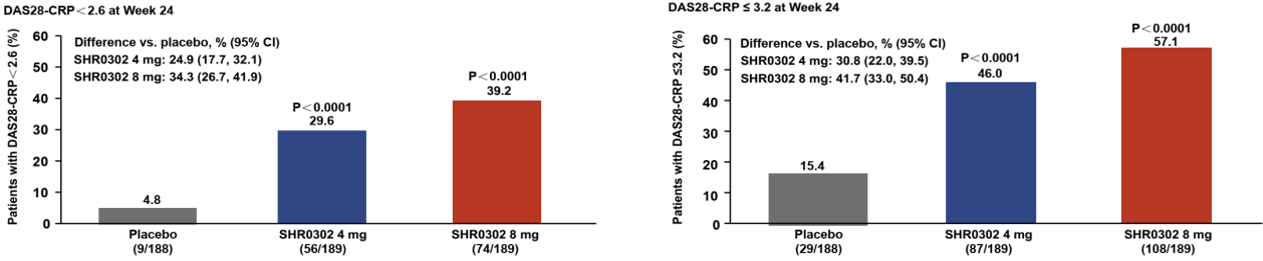
图3 各组受试者在治疗24周后das28-crp<2.6和≤3.2应答率
第24周,shr0302 4mg和8mg组的健康评估问卷残疾指数(haq-di评分)(-0.45,-0.51 vs. -0.21;p<0.0001,p<0.0001),sf-36健康调查简表心理健康(sf-36 mcs)总评分(2.85,4.04 vs. -0.22;p<0.0001,p<0.0001)和sf-36健康调查简表生理健康(sf-36 pcs)总评分(5.62,6.43 vs.1.78;p<0.0001,p<0.0001)较基线的改善均大于安慰剂组,且改善趋势一直持续至28周的延伸治疗期(图4)。
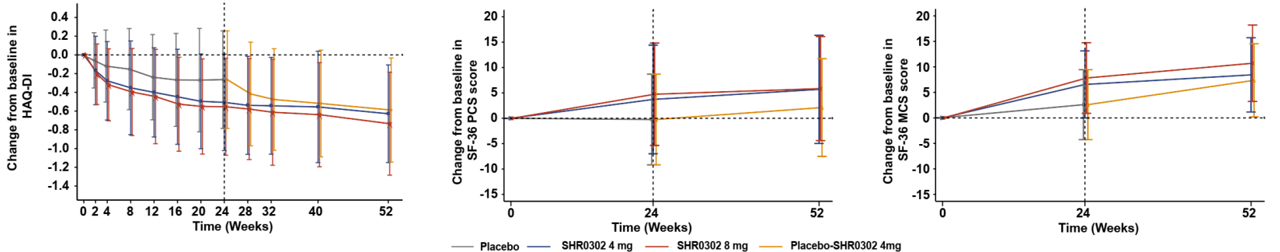
图4 各组受试者治疗52周haq-di、sf-36 mcs和sf-36 pcs相对于基线的变化情况
安全性方面:
在试验期间,未报告死亡、结核病病例或胃肠道穿孔,也未发现新的安全性事件。
研究结果表明,shr0302 4mg和8mg在控制ra的体征和症状,以及改善健康相关结局方面均具有有效性、起效快、整体安全性可控、耐受性良好的特点。
艾玛昔替尼片(shr0302)治疗活动性
强直性脊柱炎研究结果公布
强直性脊柱炎(ankylosing spondylitis,as)是一种慢性炎症性疾病,主要侵犯骶髂关节、脊柱骨突、脊柱旁软组织及外周关节,严重者可发生脊柱畸形和强直。jak抑制剂近年来被认为是治疗as的有效方法,其中jak1抑制剂的选择性更高,因此它的疗效和潜在的副作用更少[2,3]。
由北京大学人民医院栗占国教授牵头开展的“在活动性as受试者中评价shr0302片的疗效和安全性的多中心、随机、双盲、安慰剂对照的适应性无缝ii/iii期临床研究”(摘要号:pos0214)在大会公布[4]。研究结果显示[4],shr0302 4mg对非甾体抗炎药反应不足或禁忌症的活动性as受试者疾病活动度、体征和症状方面均显示出显著和持续的改善,并在24周的治疗中耐受性良好。
研究设计:
本研究纳入对至少两种非甾体抗炎药反应不足的活动性as受试者。在ii期研究中,受试者随机(1:1:1:1)口服shr0302 2mg、4mg、8mg或安慰剂连续治疗12周,然后安慰剂组的受试者重新随机(1:1:1)接受shr0302 2mg、4mg或8mg进入12周的延长治疗期,第12周进行期中分析以确定iii期的推荐剂量。在iii期研究中,受试者随机(1:1)口服shr0302 4mg或安慰剂,每日一次,连续12周;从第12周开始,所有受试者在延长治疗期间接受shr0302 4mg治疗。主要研究终点是第12周asas20应答(国际脊柱关节炎评估协会反应标准中4项重要指标至少3项达到20%改善且改善幅度≥1分,且剩余指标未恶化)的受试者比例(图5)。
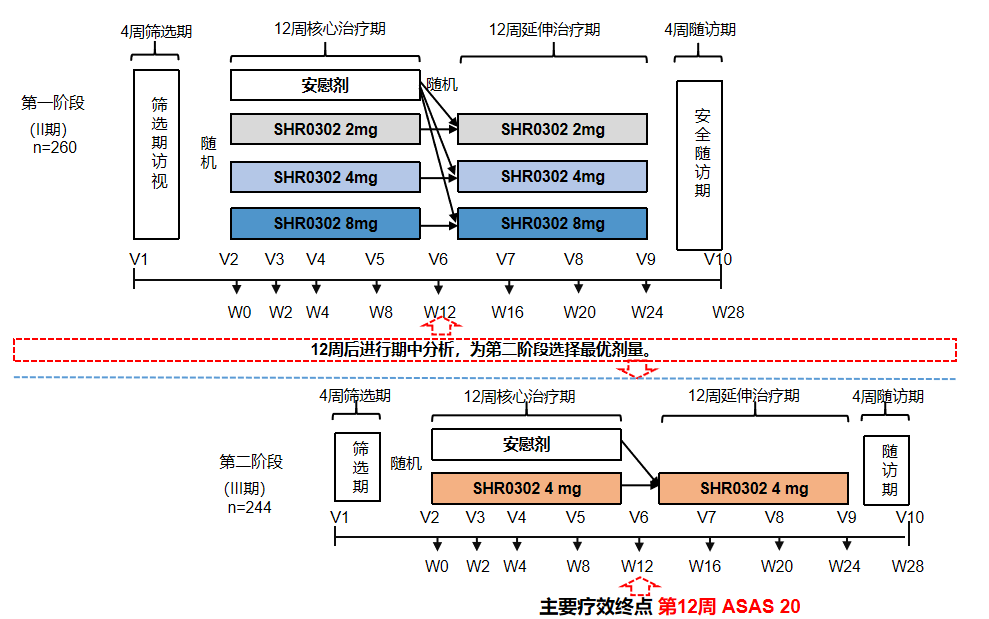
图5 研究流程设计
在ii期和iii期,187例受试者随机接受shr0302 4mg治疗,186例受试者随机接受安慰剂,所有受试者接受至少一剂研究治疗。其中,350例(93.8%)受试者完成了12周的治疗,304例(81.5%)受试者完成了24周的治疗。结果显示:
疗效方面:
第12周,shr0302 4mg组的asas20应答率为48.7%,显著高于安慰剂组的29.0%,组间差异为19.6%(p=0.0001);与安慰剂相比,shr0302 4mg组在asas40(32.1% vs. 18.3%,p=0.0011)和asas5/6应答(42.8% vs. 15.6%,p<0.0001)方面也有显著改善(图6)。
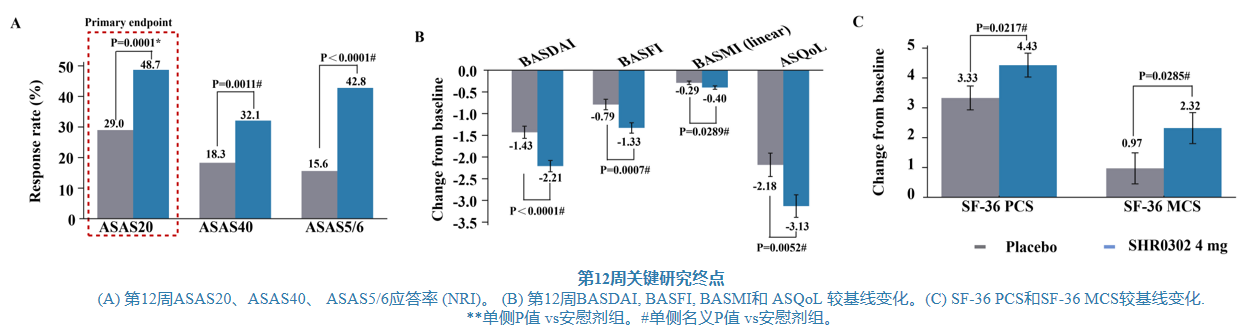
图6 第12周主要/关键研究终点
(a) 第12周asas20、asas40、 asas5/6应答率 (nri);(b) 第12周basdai, basfi, basmi和 asqol 较基线变化;(c) sf-36 pcs和sf-36 mcs较基线变化。*单侧p值 vs安慰剂组。#单侧名义p值 vs安慰剂组
第12周,shr0302 4mg组bath强直性脊柱炎病情活动指数(basdai)评分(lsm:-2.21 vs. -1.43,p<0.0001)、bath强直性脊柱炎功能指数(basfi)评分(-1.33 vs. -0.79,p=0.0007)、bath强直性脊柱炎测量指数(basmi)线性评分(-0.40 vs. -0.29,p=0.0289)、强直性脊柱炎生活质量问卷(asqol)评分(-3.13 vs. -2.18,p=0.0052)、sf-36健康调查简表生理健康(sf-36 pcs)总评分(4.43 vs. 3.33,p=0.0217)、sf-36健康调查简表心理健康(sf-36 mcs)总评分(2.32 vs. 0.97,p=0.0285)较基线变化均大于接受安慰剂治疗的受试者。在另外的12周延长治疗期间也观察到这些指标的持续改善(表1)。
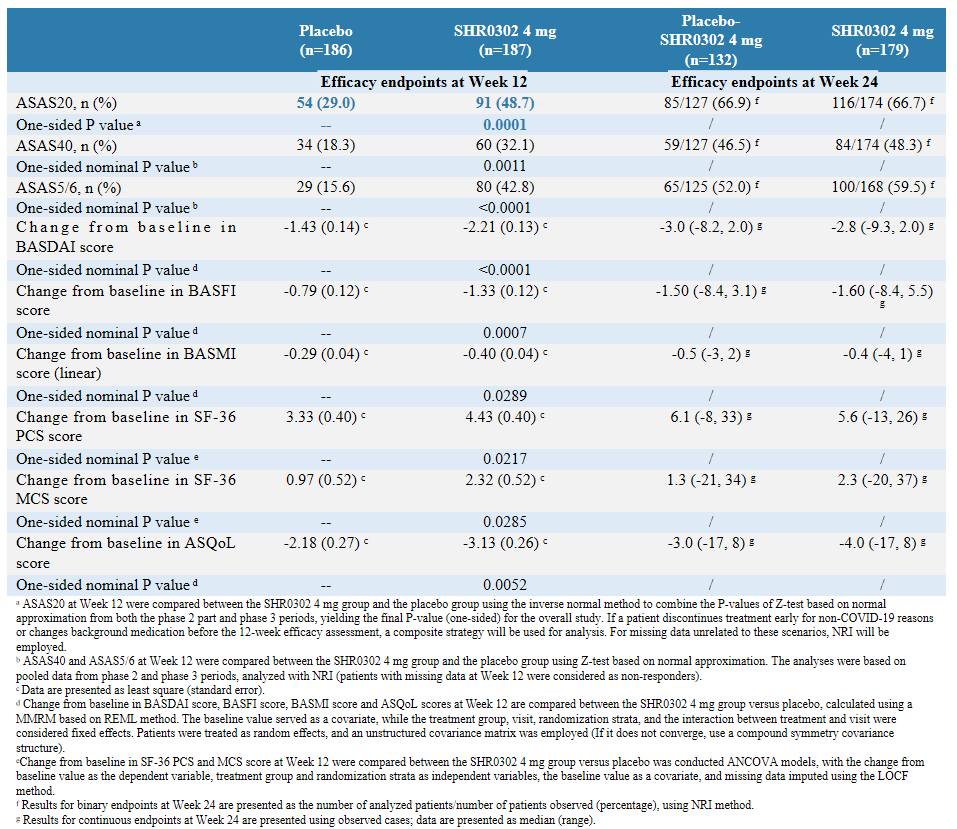
表1 主要终点和关键疗效终点
安全性方面:
在整个试验过程中,未报告死亡、结核病病例、重大心血管事件、血栓栓塞事件或新发恶性肿瘤,也未发现新的安全性事件。
研究表明,shr0302 4mg对非甾体抗炎药反应不足或禁忌症的活动性as受试者疾病活动度、体征和症状方面均显示出显著和持续的改善,并在24周的治疗中耐受性良好。
夫那奇珠单抗(shr-1314)治疗活动性
强直性脊柱炎研究结果公布
除jak抑制剂之外,il-17抑制剂也被认为是治疗as的有效方法之一[5]。夫那奇珠单抗是一种人源化的igg1抗il-17单克隆抗体药物,通过特异结合il-17从而抑制下游趋化因子配体1(cxcl1)的产生,达到阻断炎性信号传导通路的作用。
由中国人民解放军总医院黄烽教授牵头开展的“在活动性as受试者中评价shr-1314注射液的疗效和安全性的随机、双盲、多中心、安慰剂对照的适应性无缝ii/iii期临床研究” (摘要号:pos0803)在大会公布[6]。研究结果显示[6],夫那奇珠单抗120mg在第16周时较安慰剂显著改善了as受试者的症状和体征,疗效持续至32周,且安全性整体可控,耐受性良好。夫那奇珠单抗有望作为治疗活动性as的新选择。
研究设计
该研究纳入活动性as受试者,研究分为第一阶段(ii期)和第二阶段(iii期),在ii期试验中,受试者按2:2:1随机分组,分别在第0、2、4、8和12周时接受夫那奇珠单抗120mg、240mg或安慰剂治疗。所有受试者第16周完成评估后进行期中分析,独立数据监查委员会(idmc)建议iii期采用120mg作为试验药物剂量。在iii期试验中,受试者按2∶1随机分组,分别在第0、2、4、8和12周接受夫那奇珠单抗120mg或安慰剂治疗。从第16周开始,所有受试者均接受夫那奇珠单抗120mg,每4周1次,直至第32周(图7)。主要研究终点为第16周达到asas20应答的受试者比例。
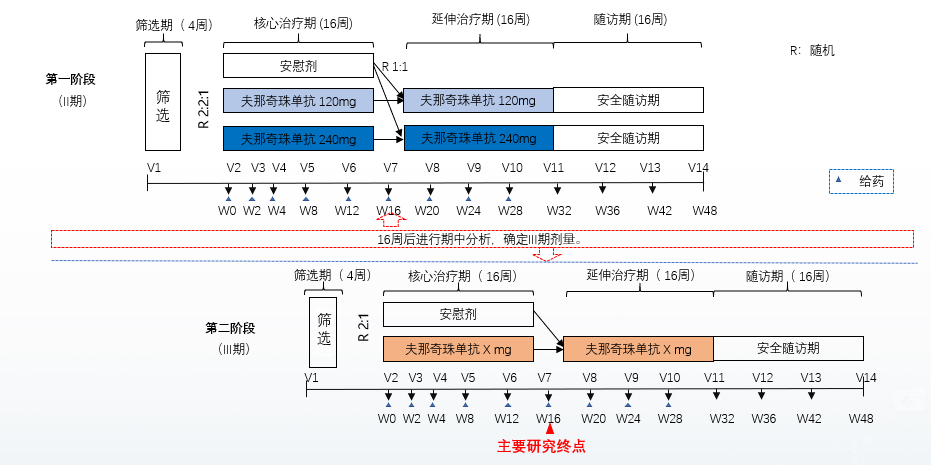
图7 研究流程设计
整体研究中共有548例受试者随机入组,夫那奇珠单抗120mg组共入组294例受试者,安慰剂组共入组146例受试者。
285例(96.9%)夫那奇珠单抗120mg组受试者和138例(94.5%)安慰剂组受试者完成了16周的核心治疗期;279例(94.9%)和133例(91.1%;转换为夫那奇珠单抗后)分别完成了整个32周治疗期。结果显示:
疗效方面:
第16周,夫那奇珠单抗120mg组的asas20应答率为65.6%,显著高于安慰剂组的42.5%,组间差异23.2%(p<0.0001);与安慰剂相比,夫那奇珠单抗120mg组在asas40(46.3% vs. 24.0%,p<0.0001)和asas5/6应答(55.4% vs. 22.6%;p<0.0001)方面也有明显改善(图8)。
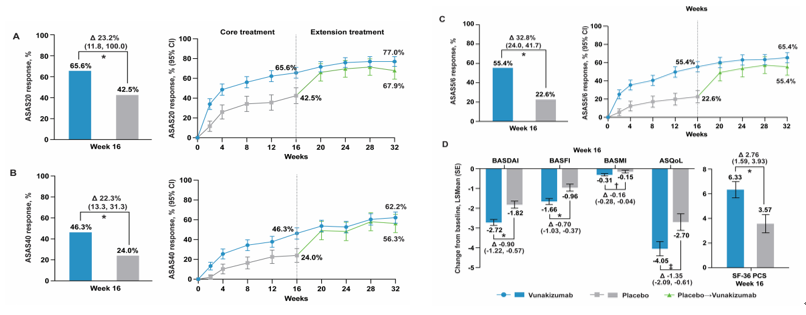
图8 研究有效性结果
*p<0.0001;†p=0.0057;‡p=0.0002。将二元变量缺失数据作为无应答进行填补,对于组间差异,提供95% ci。除左侧panel a中的asas20(单侧97.5%)外,所有95% ci均为双侧。asas应答的p值采用z检验(asas20采用逆正态法将两个阶段的p值合并),basdai、basfi、basmi和asqol采用重复测量的混合模型,sf-36 pcs采用协方差分析模型
第16周,夫那奇珠单抗120mg组basdai评分(-2.72 vs. -1.82,p<0.0001)、basfi评分(-1.66 vs. -0.96,p<0.0001)、basmi(-0.31 vs. -0.15,p=0.0057)、asqol评分(-4.05 vs. -2.70,p=0.0002)、sf-36 pcs评分(6.33 vs. 3.57, p<0.0001)较基线的改善均大于安慰剂组的受试者。夫那奇珠单抗120mg组的asas应答维持至32周(图8)。
安全性方面:
在16周核心治疗期,夫那奇珠单抗120mg组和安慰剂组的总ae发生率和感染发生率相当,在整体32周治疗期,未发生治疗相关的机会性感染、严重感染或恶性肿瘤。
研究表明,夫那奇珠单抗120mg在第16周时较安慰剂显著改善了as受试者的症状和体征,疗效持续至32周,且安全性整体可控,耐受性良好。夫那奇珠单抗有望作为治疗活动性as的新选择。
艾玛昔替尼(shr0302)已开展了包括类风湿关节炎、强直性脊柱炎、溃疡性结肠炎、特应性皮炎、斑秃等多领域的临床研究,且多数临床研究已进入iii期临床试验,强直性脊柱炎、特应性皮炎和类风湿关节炎3项适应症已进入上市申报阶段。夫那奇珠单抗(shr-1314)目前已开展了包括斑块状银屑病、银屑病关节炎等临床研究,其中斑块状银屑病、强直性脊柱炎已进入上市申报阶段。
参考文献:
[1]x zeng, j. liu, et al. a multicenter, randomized, placebo-controlled, double-blind, phase 3 study of shr0302, a selective janus kinase 1 inhibitor, in patients with active rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs.(op0037) doi: 10.1136/annrheumdis-2024-eular.1908
[2]van der heijde d, song ih, pangan al, et al. efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (select-axis 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial[j]. lancet,2019,394(10214):2108-2117.
[3 van der heijde d, deodhar a, maksymowych wp,et al.upadacitinib in active ankylosing spondylitis: results of the 2-year, double-blind, placebo-controlled select-axis 1 study and open-label extension[j].rmd open, 2022, 8(2):e002280.
[4] z. li , x. liu , c. zhao,et al. a multicenter, randomized, double-blind, placebo- controlled, phase 2/3 study of shr0302, a selective janus kinase 1 inhibitor, in patients with active ankylosing spondylitis(pos0214).doi: 10.1136/annrheumdis-2024-eular.1981
[5] ramiro s, nikiphorou e, et al. asas-eular recommendations for the management of axial spondyloarthritis: 2022 update. ann rheum dis. 2023 jan;82(1):19-34.
[6] f. huang1, j. zhu, et al. vunakizumab in active ankylosing spondylitis: a randomized, double-blind, adaptive, seamless, phase 2/3 study.(pos0803) doi: 10.1136/annrheumdis-2024-eular.868.
声明:
1.本新闻旨在分享学术前沿动态,仅供医疗卫生专业人士基于学术目的参阅,非广告用途。
2. 恒瑞医药不对任何药品和/或适应症作推荐。
3.本新闻中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。医疗卫生专业人士作出的任何与治疗有关的决定应根据患者的具体情况并遵照药品说明书。