焦点新闻
2024-03-12
2024 aad︱恒瑞自免1类创新药艾玛昔替尼治疗中重度特应性皮炎ⅲ期研究亮相口头报告
第82届美国皮肤病学会年会(aad)于2024年3月8日至12日在美国圣地亚哥隆重召开。这是全球皮肤病学领域规模最大、最具影响力的国际盛会之一。3月10日下午,知名皮肤病学专家、北京大学人民医院张建中教授在大会的最新突破性进展(late-breaking research)专场发表口头报告,向来自全球各国的皮肤病专家介绍了恒瑞医药创新药艾玛昔替尼(shr0302)治疗中重度特应性皮炎(ad)的ⅲ期研究结果[1]。
“艾玛昔替尼是中国原研的高选择性jak1抑制剂,是我们在创新药研发领域的重大突破。”张建中教授介绍,ⅲ期临床研究表明,中重度ad患者使用艾玛昔替尼治疗16周,皮损与瘙痒症状均得到了显著改善,52周的长期随访也证实,药物疗效长期持续,且整体安全性良好。

图1 张建中教授在aad上进行口头报告
研究背景
ad是一种常见的慢性、复发性、炎症性皮肤病,2019年的数据显示,全球共有1.71亿ad患者[2]。在我国,ad的患病率也不断走高,据统计,1990-2019年间,中国ad患者数增加了25.65%[3]。
ad患者往往有剧烈瘙痒,严重影响生活质量。对于中重度ad,局部药物往往不能很好地控制病情,需要启动系统治疗。传统系统治疗药物主要包括抗组胺药物、免疫抑制剂、系统应用糖皮质激素等,存在疗效不足、安全性欠佳等问题,导致患者依从性不佳、总体控制率较低[4]。生物制剂、janus激酶(jak)抑制剂等创新药物的问世,为中重度ad的治疗打开了新局面。
ad的发病机制主要包括皮肤屏障功能障碍与免疫失调。以il4/il13为主的上游th2型炎症因子是ad发病的关键和核心,下游jak-stat信号通路在ad的免疫反应失调中起到重要作用[5]。因此近年来,jak-stat通路已经被公认为ad领域极具潜力的治疗靶点。
艾玛昔替尼(shr0302)是恒瑞医药自主研发的1类新药、新一代高选择性jak1抑制剂,对jak1的选择性是对jak2的16倍。该药物能通过高选择性抑制jak1,调节il-4、il-5、il-13、ifn-γ和其他参与ad发病机制的细胞因子的信号传导。因其对jak2的抑制性极低,也能尽量降低发生中性粒细胞减少症与贫血的风险[5]。ⅱ期临床研究表明,艾玛昔替尼治疗中重度ad效果良好,且耐受性良好[6],有望在未来为国内广大ad患者提供一项新的治疗选择。
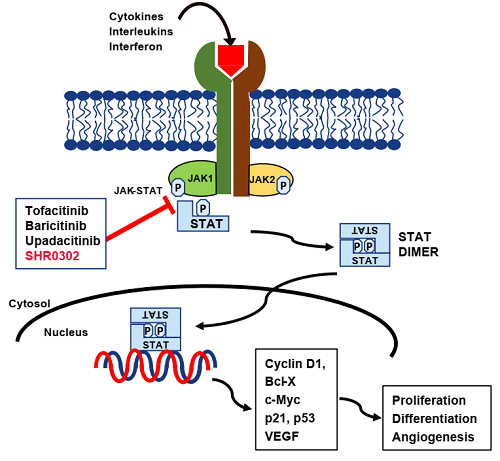
图2 jak-stat通路介导ad相关细胞因子的信号转导
研究设计
在本次aad上,张建中教授介绍了艾玛昔替尼治疗中重度ad的ⅲ期研究长期结果[1]。这项多中心、随机、双盲、安慰剂对照的ⅲ期临研究纳入了来自中国与加拿大的53个医学中心的336例中重度ad患者。患者的入组标准包括:
①年龄范围为12-75岁;
②确诊为中重度ad;
③既往使用外用糖皮质激素(tcs)、钙调磷酸酶抑制剂(tci)疗效不佳或无法耐受,或在筛选前6个月内需要使用系统疗法。
入组患者按1:1:1随机分为三组,分别接受艾玛昔替尼4mg qd(每天给药一次)、艾玛昔替尼8mg qd与安慰剂,共治疗16周,随后是双盲扩展阶段,安慰剂组的患者将按1:1被重新随机分配,进入两个艾玛昔替尼治疗组。
研究的共同主要终点为16周时实现研究者总体评估(iga)应答与湿疹面积和严重度指数改善75%(easi-75)的患者比例,长期终点包括52周治疗期内实现iga应答与easi-75应答的患者比例、实现最严重瘙痒强度数值评定量表(wi-nrs)应答(wi-nrs改善≥4分)的患者比例与整个治疗期间内的药物安全性与耐受性。
研究结果
在已发布的初步结果中,艾玛昔替尼治疗中重度ad的ⅲ期临床研究达到了共同主要终点。结果显示,艾玛昔替尼治疗青少年与成人中重度ad患者,对疾病活动度与瘙痒症状的改善显著优于安慰剂,且安全性与耐受性良好。
16周时,艾玛昔替尼4mg组、8mg组与安慰剂组的iga应答率分别为36.3%、42.0%、9.0%,表明该药物能有效改善中重度ad的疾病活动度。
在改善皮损方面,艾玛昔替尼也展示了显著的疗效。16周时艾玛昔替尼4mg组、8mg组与安慰剂组的easi-75应答率分别为54.0%、66.1%、21.6%。
艾玛昔替尼还能显著改善受试者的瘙痒症状。16周时,艾玛昔替尼4mg组、8mg组、安慰剂组的wi-nrs应答率分别为37.2%、40.2%与12.6%。
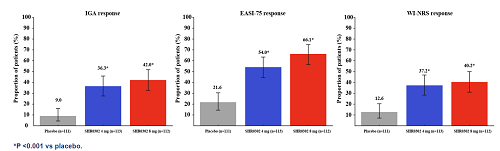
图3 ⅲ期临床研究主要终点
完成16周的治疗阶段后,共有300例患者进入扩展阶段。最终,258例患者完成了52周的治疗。
皮损持续改善
结果显示,从基线开始持续使用艾玛昔替尼治疗的患者中,第16周到第52周的治疗期内,iga与easi-75的应答率仍能长期维持,52周时,艾玛昔替尼4mg组与8mg组的iga应答率分别为42.3%与40.2%;easi-75应答率分别为60.6%与55.9%。
瘙痒显著缓解
在瘙痒方面,从基线开始持续使用艾玛昔替尼治疗的患者中,从第16周到第52周的治疗期内,wi-nrs应答率同样维持稳定。52周时,艾玛昔替尼4mg组与8mg组的wi-nrs应答率分别为59.6%与45.1%。
生活质量提高
在从基线开始持续使用艾玛昔替尼治疗的患者中,早在第1次评估时,就观察到了多个患者报告结局(pro)的显著改善,第16周至第52周的治疗期内疗效持续。52周时,艾玛昔替尼4mg组与8mg组的儿童皮肤病生活质量指数/皮肤病生活质量指数(cdlqi/dlqi)相较于基线的降幅高达-8.3分与-8.5分,特应性皮炎/湿疹自我检查评分量表(poem)评分的降幅分别为-11.7分与-11.9分。
整体安全耐受
在52周的治疗期间内,艾玛昔替尼4mg组与8mg组不良事件发生率基本相当,且多为轻度,因不良反应导致的停药较少,未报告恶性肿瘤、主要心血管事件(mace)或血栓栓塞事件,未出现新的安全信号。
总结
张建中教授表示,艾玛昔替尼的成功研发,对国内广大ad患者而言无疑是一个振奋人心的利好消息。这一创新药物的诞生,不仅为患者提供了新的治疗选择,更展现了民族药企在自主创新方面的强大实力,为打破进口药物的垄断局面提供了有力的示范。近年来,中国新药研发企业如雨后春笋般涌现,推出的新药也越来越多,其中不乏领先国际的创新药物。他期待在未来,中国的新药研发取得更多突破,为全球患者提供更多疗效高、安全性好的新药,为祖国争光。
作为植根中国的创新型国际化制药企业,恒瑞医药在深耕传统优势的肿瘤领域的同时,积极开辟新赛道,塑造发展新动能、新优势。目前在慢病领域,公司共有58款创新产品在研,涵盖代谢性疾病、自身免疫疾病、呼吸系统疾病、神经系统疾病、心血管疾病、感染疾病、血液疾病、疼痛管理、眼科等多个领域。
在自身免疫领域,经过多年的沉淀和布局,公司已有10余款产品在研。其中艾玛昔替尼目前已开展了包括类风湿关节炎、强直性脊柱炎、溃疡性结肠炎、特应性皮炎、斑秃等多领域的临床研究,其中绝大多数适应症的临床研究已进入iii期临床试验,溃疡性结肠炎和中重度特应性皮炎两项国际多中心ⅲ期项目正在推进中,强直性脊柱炎、特应性皮炎和类风湿关节炎3项适应症的上市申请均已获得国家药监局受理。2018年,公司将艾玛昔替尼许可给美国arcutis公司,让公司创新药品惠及全球患者。
未来,恒瑞医药将继续坚持“以患者为中心”的理念,重创新,强研发,力争研制出更多更好的新药,努力守护患者健康生活和生命质量。
参考文献:
[1] zhang jianzhong.long-term efficacy and safety of shr0302 in patients with moderate-to-severe atopic dermatitis:52-week results from a phase 3 study.aad 2023 annual meeting; march 8-12. (oral presentation).
[2]faye o, flohr c, kabashima k, et al. atopic dermatitis: a global health perspective. j eur acad dermatol venereol. 2023 dec 27.
[3]dong wl , an j , yu m ,et al. the prevalence and year lived with disability of atopic dermatitis in china: findings from the global burden of disease study 2019[j]. world allergy organ j, 2021,14(11):100604.
[4]中华医学会皮肤性病学分会,中国医师协会皮肤科医师分会. 中国中重度特应性皮炎诊疗临床路径专家共识(2023版)[j]. 中华皮肤科杂志,2023,56(11):1000-1007.
[5]zhao y, zhang l, ding y, et al.efficacy and safety of shr0302, a highly selective janus kinase 1 inhibitor, in patients with moderate to severe atopic dermatitis: a phase ii randomized clinical trial. am j clin dermatol. 2021 nov;22(6):877-889.
[6] aad 2023 annual meeting; march 17-21. (oral presentation).
声明:
1. 本新闻旨在分享研发前沿资讯,仅供医疗卫生专业人士基于学术目的参阅,非广告用途。
2. 恒瑞医药不推荐任何未被批准的药品、适应症的使用。