新闻速递
2023-11-01
喜讯!恒瑞创新药吡咯替尼乳腺癌研究荣登国际顶刊《英国医学杂志》
10月31日,恒瑞医药创新药吡咯替尼(艾瑞妮®)或安慰剂联合曲妥珠单抗和多西他赛作为her2阳性转移性乳腺癌患者的一线治疗研究(phila)正式在线发表于国际四大顶级医学期刊之一——《英国医学杂志》(british medical journal,简称bmj;影响因子:105.7)[1]。该研究由中国医学科学院肿瘤医院徐兵河院士牵头开展,这是乳腺癌领域中国自主研发药物临床研究刊登的影响因子最高的国际期刊。
该研究结果显示,吡咯替尼联合曲妥珠单抗和多西他赛一线治疗her2阳性晚期乳腺癌患者具有显著的pfs获益和可控的安全性,中位无进展生存期(mpfs)达24.3个月[1],突破两年的中位无进展生存期。
正是基于该研究的出色成果,今年4月,国家药监局(nmpa)批准吡咯替尼与曲妥珠单抗和多西他赛联合用于her2阳性晚期乳腺癌一线治疗,这是吡咯替尼在中国获批的第三个适应症,也是中国首个获批的受体酪氨酸激酶抑制剂(tki)联合大分子抗体药物用于治疗晚期乳腺癌的双靶组合,为此类患者带来用药新选择。
中位无进展生存期突破2年
吡咯替尼为her2阳性晚期乳腺癌患者
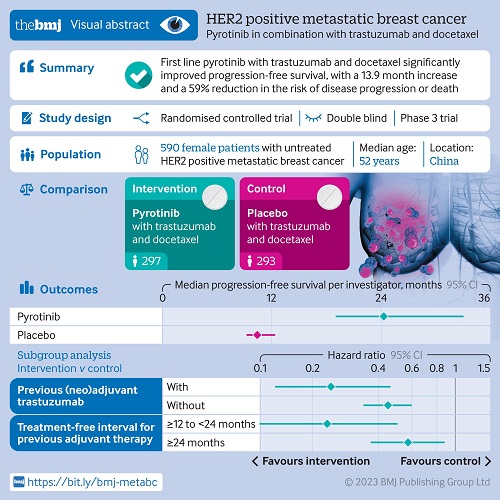
带来显著生存获益phila研究是由徐兵河院士牵头开展的一项随机、双盲、平行对照、多中心的ⅲ期临床试验,全国40家中心共同参与,共入组590例受试者,旨在评估吡咯替尼 曲妥珠单抗 多西他赛(pyht)方案对比安慰剂联合曲妥珠单抗和多西他赛一线治疗her2阳性复发/转移性乳腺癌的疗效和安全性。研究结果于2022年欧洲肿瘤内科学会(esmo)年会(lba19)首次亮相[2]。
在总人群中,研究者(inv)评估的中位pfs长达24.3个月,相比对照组的10.4个月,显著延长超过一倍(hr=0.41,95%ci 0.32-0.53;p<0.0001),降低疾病进展和死亡风险59%。独立评审委员会(irc)评估的中位pfs,pyht组长达33.0个月,而对照组仅为10.4个月(hr=0.35,95%ci 0.27-0.46)。pyht方案突破两年的中位pfs令人鼓舞,这也是目前公布的her2阳性晚期乳腺癌iii期临床研究一线治疗中的最长pfs中位值。
此外,phila研究纳入了大约15%的曲妥珠单抗经治患者,亚组分析表明,无论是否曲妥珠单抗经治,pyht组相比对照组都有显著pfs获益,其中经治患者:nr vs 9.3个月(hr=0.23, 95%ci 0.12-0.46);未经治患者:21.9个月 vs 10.4个月(hr=0.45, 95% ci 0.34-0.59)。而既往cleopatra研究[3]显示,曲妥珠单抗未经治患者相比经治患者的pfs获益更大,这提示对于已对单克隆抗体产生耐药性的患者,后续小分子酪氨酸激酶抑制剂(tki)治疗可获得比继续接受单克隆抗体治疗更好的疗效。在曲妥珠单抗(新)辅助治疗广泛应用的当下,pyht方案有望更大程度解决既往抗her2治疗耐药问题,为her2阳性晚期乳腺癌患者提供新的一线治疗选择。
phila研究中289例患者(49%)既往未接受过(新)辅助全身治疗(其中大约93%的患者为新发iv期),pyht组中位pfs达到19.5个月(对照组中位pfs为10.3个月)。这一结果填补了既往研究未纳入新发iv期her2阳性乳腺癌患者的空白,对于临床实践具有重要指导意义。
国内权威指南共同推荐
为患者提供一线治疗新选择
乳腺癌已成为全球第一大恶性肿瘤,是女性最常见的恶性肿瘤之一。统计数据表明[4],2020年全球新确诊的女性乳腺癌发病人数约有226.1万例,占女性所有新发恶性肿瘤病例的24.5%。her2分子是乳腺癌预后较差的独立预测因子,her2阳性乳腺癌大约占20-25%[5],且药物选择性单一,临床应用中存在着巨大未被满足的临床需求。
基于phila研究的突破性成果,pyht方案得到国内三大权威指南《中国晚期乳腺癌规范诊疗指南(2022版)》[6]、《中国抗癌协会诊治指南与规范(2022年精要版)》[7]、《csco乳腺癌诊疗指南(2023年)》[8]共同推荐作为一线治疗新选择。这意味着pyht方案正式跻身中国her2阳性晚期乳腺癌一线治疗队列,开启了中国her2阳性晚期乳腺癌一线治疗的新篇章。
吡咯替尼成果亮眼
恒瑞医药用创新守护生命健康
吡咯替尼是恒瑞自主研发并拥有知识产权的口服her1、her2、her4酪氨酸激酶抑制剂(tki),是中国首个自主研发的抗her1/her2/her4靶向药。
2018年,吡咯替尼凭借ⅱ期临床研究获国家药品监督管理局附条件批准上市,是实体瘤领域中国首个凭借ⅱ期临床研究获附条件批准上市的创新药。2019年,吡咯替尼被纳入国家医保目录;2020年,吡咯替尼凭借两项重要ⅲ期研究(phenix、phoebe)结果获得完全批准上市,联合卡培他滨用于治疗her2阳性、接受过曲妥珠单抗治疗的复发或转移性乳腺癌患者。2022年,吡咯替尼获批第二个适应症,联合曲妥珠单抗和多西他赛用于her2阳性早期或局部晚期乳腺癌患者的新辅助治疗。2023年,吡咯替尼获批第三个适应症,与曲妥珠单抗和多西他赛联合,适用于治疗her2阳性、晚期阶段未接受过抗her2治疗的复发或转移性乳腺癌患者。2023年7月,吡咯替尼和注射用shr-a1811获批在晚期实体瘤受试者中开展安全性、耐受性及有效性的ⅰb/ⅱ期临床研究。该产品正在美国、欧洲和亚太地区开展临床研究。
吡咯替尼已有多项乳腺癌研究成果发表于国际著名学术期刊,并多次登上美国临床肿瘤学会(asco)年会等学术盛会。吡咯替尼联合卡培他滨的剂量爬坡ⅰb期研究发表于《临床肿瘤学杂志》(jco),开创了中国自主研发抗肿瘤药物仅凭ⅰ期临床研究就登上国际权威学术期刊的先河。随后,吡咯替尼联合卡培他滨的ⅱ期临床研究再次登上jco;同时,这项ⅱ期临床研究被2017年美国圣安东尼奥乳腺癌研讨会(sabcs)列入2017年乳腺癌重大事件年度回顾之一,得到了国内外同行的高度评价与一致认可。奠定吡咯替尼 卡培他滨晚期二线标准治疗地位的iii期phoebe研究,曾分别闪耀2020年asco oral和2021年sabcs oral,并且该研究全文发表于《柳叶刀·肿瘤学》,见证了吡咯替尼成为国内首个登顶《柳叶刀·肿瘤学》的抗her2小分子靶向药物。
吡咯替尼亮眼成绩背后,是恒瑞医药锚定创新、勇于开拓的韧劲。自2011年公司首款创新药获批上市以来,恒瑞医药累计研发投入超330亿元,位居国内同行前列,并在美国、欧洲、澳大利亚、日本和中国多地设立14个研发中心,全球研发团队达5000余人。目前,公司已有13款自主研发的1类创新药、1款自主研发的2类改良型新药及2款合作引进创新药在国内获批上市,另有80多个自主创新产品正在临床开发,270多项临床试验在国内外开展,研发成果稳居行业领先地位。
未来,恒瑞医药将继续坚持“以患者为中心”的理念,重创新,强研发,力争研制出更多更好的新药,服务健康中国,惠及全球患者。
参考文献
[1] xu bh,ma f, yan m, et al. pyrotinib versus placebo in combination with trastuzumab and docetaxel as first line treatment in patients with her2 positive metastatic breast cancer (phila): randomised, double blind, multicentre, phase 3 trial. bmj 2023;383:e076065.
[2] xu bh, yan m, ma f, et al. pyrotinib or placebo in combination with trastuzumab and docetaxel for her2-positive metastatic breast cancer (phila): a randomized phase 3 trial. 2022 esmo. abstract lba19.
[3] swain sm, miles d, kim sb, et al; cleopatra study group. pertuzumab, trastuzumab, and docetaxel for her2-positive metastatic breast cancer (cleopatra): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. lancet oncol. 2020 apr;21(4):519-530.
[4] sung h, ferlay j, siegel rl, et al: global cancer statistics 2020: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. ca cancer j clin 71:209-249, 2021.
[5] 2022 nccn guideline-breast cancer.
[6]《中国晚期乳腺癌规范诊疗指南(2022年版)》
[7]《中国抗癌协会诊治指南与规范(2022年精要版)》
[8]《中国临床肿瘤学会(csco)乳腺癌诊疗指南》