焦点新闻
2022-12-28
恒瑞创新药卡瑞利珠单抗治疗复发转移性宫颈癌研究成果登上《自然》子刊
近日,由复旦大学附属肿瘤医院吴小华教授牵头开展的“卡瑞利珠单抗联合苹果酸法米替尼治疗复发转移性宫颈鳞状细胞癌的ii期临床研究”结果发表于国际知名杂志《自然》杂志子刊《自然·通讯》(nature communications,if 17.694)[1] ,研究结果显示orr达到39.4%,中位pfs达到10.3个月,12个月os率为77.7%,且安全性可接受,为复发转移性宫颈癌提供新的治疗组合。

《卡瑞利珠单抗联合苹果酸法米替尼治疗复发转移性宫颈鳞状细胞癌的ii期临床研究》发表于nature communications
研究背景
针对无法通过局部根治性手术或放疗的复发转移性宫颈癌患者,首选含铂化疗联合贝伐珠单抗,但大多数患者治疗后仍会出现疾病进展[2]。基于keynote-158研究,fda批准帕博利珠单抗用于治疗化疗后进展的、pd-l1表达阳性(cps≥1)的复发或转移性宫颈癌,其orr为14.3%[3]。西米普利单抗和那武利尤单抗治疗既往治疗失败的复发转移性宫颈癌疗效有限,其orr分别为16.4%和26.3%[4-5]。抗pd-1抗体联合其他药物治疗既往治疗失败的复发转移性宫颈癌患者orr在0%-31.8%[6-9],提示抗pd-1/pd-l1抗体联合治疗有望进一步提高复发转移性宫颈癌的疗效。
法米替尼是由恒瑞自主研发的小分子多靶点酪氨酸激酶抑制剂。本研究探索卡瑞利珠单抗联合苹果酸法米替尼治疗复发转移性宫颈鳞状细胞癌的疗效和安全性。
研究设计
本研究为多中心、开放、单臂的ⅱ期临床试验,旨在评价卡瑞利珠单抗联合苹果酸法米替尼治疗晚期泌尿系统肿瘤和妇科肿瘤患者的有效性和安全性。队列5入组复发转移阶段经过1-2线系统治疗失败的宫颈鳞状细胞癌患者,接受卡瑞利珠单抗(200mg 每3周一次)联合苹果酸法米替尼(20mg 每日一次)治疗。主要研究终点为基于recist 1.1标准评估的客观缓解率(orr)。

图1 研究设计
研究结果
本研究共入组33例复发转移性宫颈鳞状细胞癌患者。19例患者接受pd-l1检测,其中10例患者pd-l1表达阳性,9例患者表达阴性。33例患者既往均接受过紫杉类系统治疗,32例患者既往接受过含铂系统治疗。
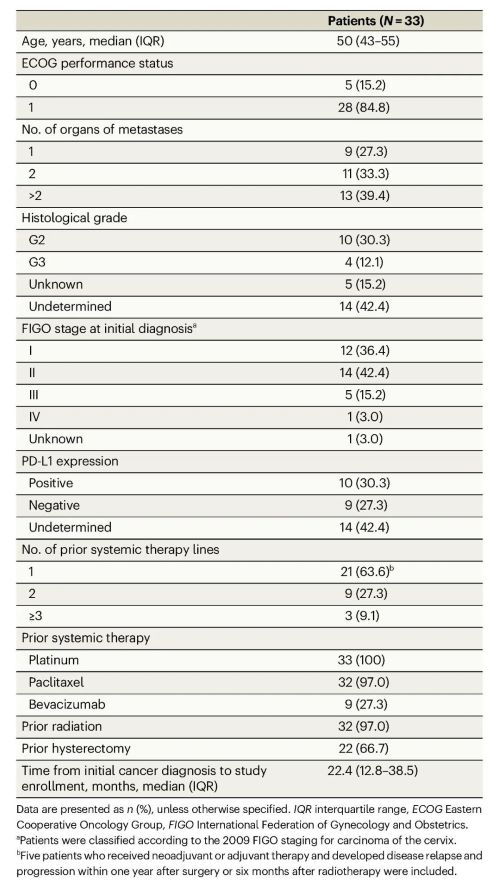
表1 患者基线特征
截止2021年6月8日,中位随访时间为13.6个月(iqr:10.0-23.6个月),11例患者继续接受治疗中。总人群的orr为39.4% (95% ci:22.9-57.9),dcr为69.7% (95% ci:51.3-84.4)。pd-l1表达阳性的患者orr为40.0%(95% ci:12.2-73.8),dcr为80.0%(95% ci:44.4-97.5)。pd-l1表达阴性的患者orr为33.3%(95% ci:7.5-70.1),dcr为55.6%(95% ci:21.2-86.3)。
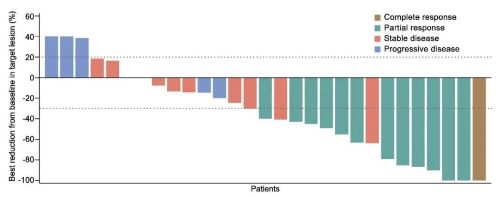
图2 靶病灶大小的最佳变化
中位dor尚未达到,12个月的dor率为74.1% (95% ci:39.1-90.9)。
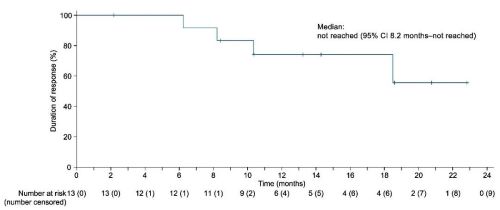
图3 dor的k-m曲线
中位pfs为10.3个月(95% ci:3.5-nr),中位os尚未达到,12个月的os率为77.7%(95% ci:58.9-88.7)。
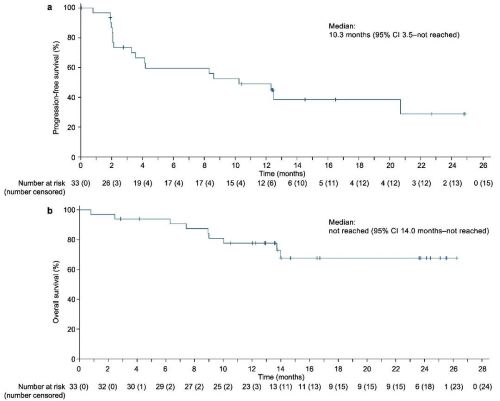
图4 pfs和os的k-m曲线
研究总结
本研究结果显示,卡瑞利珠单抗联合苹果酸法米替尼在既往系统治疗失败的复发转移性宫颈鳞状细胞癌患者中显示出持续的抗肿瘤效果和可控的安全性,为复发转移性宫颈癌提供新的治疗选择。
参考文献:
[1] xia, l., zhou, q., gao, y. et al. a multicenter phase 2 trial of camrelizumab plus famitinib for women with recurrent or metastatic cervical squamous cell carcinoma. nat commun 13, 7581 (2022). https://doi.org/10.1038/s41467-022-35133-4.
[2] national comprehensive cancer network. nccn clinical practice guidelines in oncology. cervical cancer. version 1. https://www.nccn.org/professionals/physician_gls/pdf/cervical.pdf (accessed november 16, 2021) (2022).
[3] chung, h. c. et al. efficacy and safety of pembrolizumab in previously treated advanced cervical cancer: results from the phase ii keynote-158 study. j. clin. oncol. 37, 1470–1478 (2019).
[4] tewari, k. s. et al. survival with cemiplimab in recurrent cervical cancer. n. engl. j. med. 386, 544–555 (2022).
[5] naumann, r. w. et al. safety and efficacy of nivolumab monotherapy in recurrent or metastatic cervical, vaginal, or vulvar carcinoma: results from the phase i/ii checkmate 358 trial. j. clin.oncol. 37, 2825–2834 (2019).
[6] o’malley, d. m. et al. lba34 single-agent anti-pd-1 balstilimab or in combination with anti-ctla-4 zalifrelimab for recurrent/metastatic (r/m) cervical cancer (cc): preliminary results of two independent phase ii trials. ann. oncol. 31, s1164–s1165 (2020).
[7] naumann, r. w. et al. lba62 - efficacy and safety of nivolumab (nivo) ipilimumab (ipi) in patients (pts) with recurrent/metastatic (r/m) cervical cancer: results fromcheckmate 358. ann. oncol. 30, v898–v899 (2019).
[8] oaknin, a. et al. lio-1: initial phase 2 experience of lucitanib nivolumab in patientswithmetastatic or recurrent cervical cancer (nct04042116; engot-gyn3/ago/lio). society of gynecologic oncology. https://clovisoncology.com/files/sgo2022_oaknin_oral.pdf (accessed august 16, 2022) (2021)
[9] friedman, c. f. et al. phase ii study of atezolizumab in combination with bevacizumab in patients with advanced cervical cancer. j. immunother. cancer https://doi.org/10.1136/jitc-2020-001126 (2020).